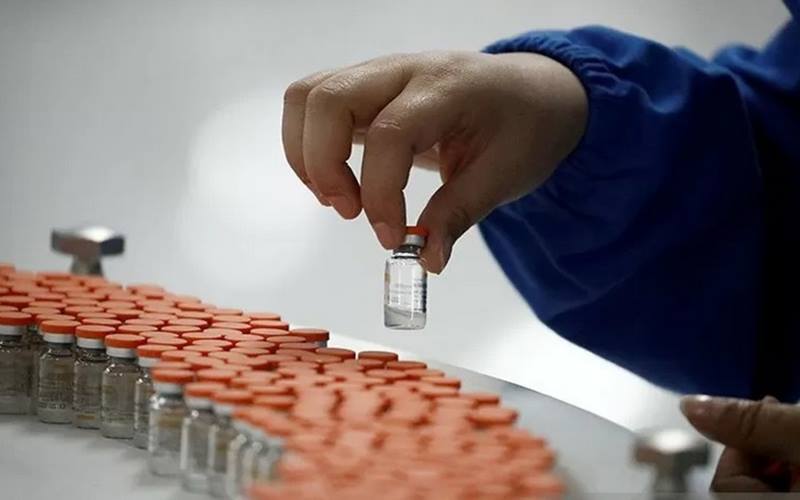
Bisnis.com, JAKARTA — Badan Pengawas Obat dan Makanan (BPOM) secara resmi telah menyerahkan setifikat CPOB atau Cara Pembuatan Obat yang Baik vaksin Covid-19 yang saat ini berada di PT Bio Farma (Persero).
BPOM mencatat saat ini Indonesia memiliki 1,2 juta dosis vaksin Covid-19 dari Sinovac Life Science awal Desember 2020, dan menyusul segera tiba 1,8 juta dosis berikutnya. Selain mendatangkan 3 juta dosis vaksin jadi tersebut, Indonesia akan mengimpor 15 juta dosis bulk vaksin untuk dilakukan proses fill and finish product di PT Bio Farma.
Kepala BPOM Penny K. Lukito mengatakan pihnya akan terus mengawal setiap proses penyediaan vaksin Covid-19 untuk memastikan keamanan, khasiat atau efikasi, dan mutu vaksin tersebut. Salah satu tahapan dalam aspek pengawalan mutu vaksin adalah inspeksi Cara Pembuatan Obat yang Baik (CPOB) di sarana produksi, baik di tempat asal pembuatan vaksin dalam hal ini di Sinovac Life Science Beijing maupun di sarana produksi PT Bio Farma.
“Kami telah melakukan inspeksi dan proses verifikasi terhadap tahapan proses produksi dan penjaminan mutu di sarana produksi Bio Farma tersebut. Hasil evaluasi dan verifikasi menunjukkan bahwa sarana produksi telah memenuhi syarat sehingga sertifikat CPOB dapat diterbitkan," kata Penny yang dikutip Bisnis, Senin (4/1/2021).
Dengan penerbitan sertifikat CPOB ini, proses fill and finish product dapat segera dilakukan setelah bulk vaksin tiba.
Bio Farma telah memiliki fasilitas ruang produksi fill and finish vaksin Covid-19 dengan kapasitas produksi 100 juta dosis per tahun. Tahap selanjutnya Bio Farma segera menyiapkan fasilitas produksi dengan kapasitas 150 juta dosis, sehingga tahun depan dapat memproduksi hingga total 250 juta dosis per tahun.
Baca Juga
Saat ini proses pemberian Emergency Use Authorization (EUA) vaksin asal Sinovac telah memasuki tahapan penyelesaian. Peneliti yang melakukan uji klinik vaksin di Bandung bersama Bio Farma sebagai sponsor sedang menganalisis data-data uji klinik sebagai data dukung khasiat dan keamanan vaksin dalam pemberian EUA.
"Kami terus memantau pelaksanaan uji klinik dan mengevaluasi hasil uji klinik untuk memastikan vaksin yang akan digunakan aman dan berkhasiat," ujar Penny.
Direncanakan, uji klinik vaksin Sinovac di Indonesia dilakukan pada 1.600 subjek. Saat ini seluruh subjek telah mendapat pemberian 2 kali suntikan, untuk selanjutnya dilakukan pemantauan keamanan dan khasiatnya secara periodik yaitu 1 bulan, 3 bulan dan 6 bulan setelah penyuntikan.
Untuk pembuktian keamanan vaksin dilakukan pemantauan kejadian efek samping yang timbul setelah penyuntikan, sedangkan pembuktian khasiat vaksin dilakukan dengan pengukuran antibodi yang terbentuk dalam tubuh dan kemampuannya dalam melakukan netralisasi terhadap virus yang masuk, serta penghitungan efikasi vaksin.
Pengukuran netralisasi antibodi pada uji klinik vaksin ini dilakukan menggunakan virus dari pasien di Indonesia yang dilakukan di laboratorium Balitbangkes Kementerian Kesehatan.
Dengan data tersebut, dapat diketahui kemampuan vaksin dalam membunuh virus. Data preliminary telah diperoleh dan telah dibahas dengan tim Komite Nasional (Komnas) Penilai Obat, dengan hasil yang baik. Selanjutnya Badan POM menunggu hasil perhitungan efikasi vaksin yang saat ini sedang disiapkan oleh peneliti.
Selain melakukan evaluasi terhadap data uji klinik vaksin yang dilakukan di Bandung, Badan POM juga akan mendapatkan data dukung khasiat dan keamanan vaksin dari uji klinik di China, Brasil, dan Turki. BPOM telah melakukan diskusi dengan otoritas obat di negara-negara tersebut untuk melakukan sharing data.
Penny pun menegaskan tahapan-tahapan dalam proses pemberian EUA telah berjalan sesuai dengan standar internasional. Meskipun dalam kondisi kedaruratan Covid-19 diperlukan kecepatan dalam penyediaan vaksin, pengambilan keputusan pemberian persetujuan penggunaan darurat ini harus dilakukan dengan pertimbangan kemanfaatan yang lebih tinggi dari risikonya.
BPOM bersama tim pakar di bidang vaksin, Indonesian Advisory Group on Immunization (ITAGI) dan Anggota Komnas Penilai Obat akan membahas dengan seksama sebelum pemberian persetujuan tersebut.